2006 (613)
2007 (556)
2008 (369)
2009 (298)
2011 (232)
2012 (174)
2013 (145)
2014 (89)
2015 (101)
2016 (83)
2017 (53)
2019 (76)
2021 (62)
2022 (116)
2023 (95)
2024 (62)
2026 (1)

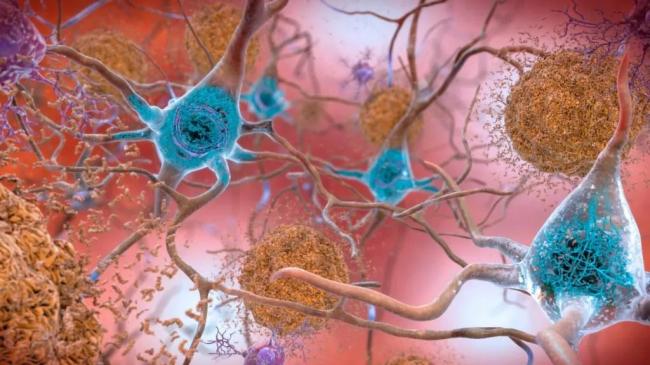
美國食品藥品管理局(FDA)的專家小組一致同意,批準一款名為lecanemab的藥物,用於臨床治療阿爾茨海默氏病(也被稱為“老年癡呆症”)。
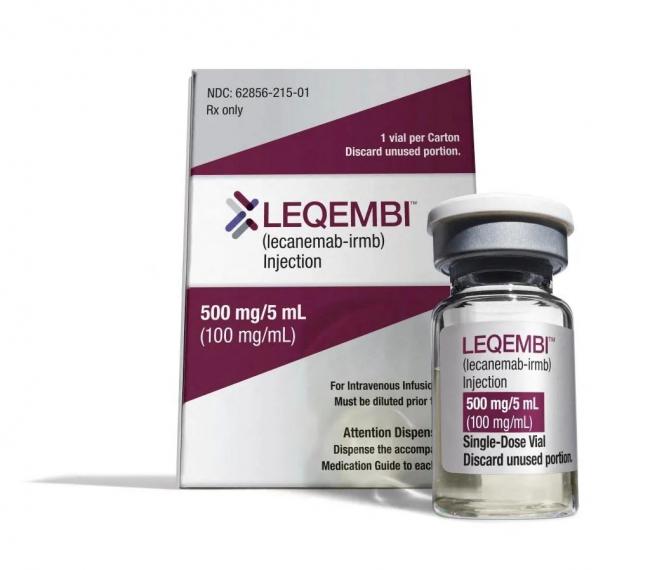
這意味著,這種以 Leqembi品牌銷售的藥物應該會在7月6日之前獲得 FDA的全麵批準,美國650萬患有老年癡呆症的病人有望獲得首批藥物。至於其他國家,有些全部采用FDA標準的國家也能得到藥物,而有些自己有類似官方機構的國家,則要自己評估再決定是否引進這種藥物。
與所有藥物一樣,lecanemab在FDA的監管下進行了大型的雙盲試驗,該實驗招募了800多名早期老年癡呆症患者,並測試了不同劑量的 Leqembi所產生的效果。結果表明,在18個月的試驗周期裏,使用了lecanemab進行治療的患者,與安慰劑相比,輕度認知障礙或阿爾茨海默氏癡呆患者的認知能力下降速度要慢27%。
在生活表現來看,接受lecanemab治療的患者,在日常生活中的表現也優於安慰劑的患者,比如自己穿衣服和吃飯。
FDA在今年年初批準了該藥物的緊急使用授權,在經過半年的臨床試驗後,FDA專家確認該藥物的確對老年癡呆症患者有益,因此全麵批準了lecanemab在美國上市,按照程序,有望在7月6日之前拿到正式批文。
 不過,控製醫療保險的醫療保險和醫療補助服務中心表示,隻會為在國家登記處注冊的患者提供該藥物,而如何注冊成為難題。
不過,控製醫療保險的醫療保險和醫療補助服務中心表示,隻會為在國家登記處注冊的患者提供該藥物,而如何注冊成為難題。
美國阿爾茨海默氏症協會抨擊這種官僚主義的做法,稱該障礙“是不必要的且可能有害的障礙”。
“醫療保險應該是美國人的堅如磐石的保證,現在是“醫療保險和醫療補助服務中心”加強並在 FDA傳統批準之日提供醫療保險訪問的時候了。”阿爾茨海默氏症協會在一份聲明中說聲明,“患有阿爾茨海默氏病的美國人應該無障礙地獲得 FDA批準的治療,就像患有癌症、心髒病和艾滋病毒/艾滋病的人一樣。”該倡導組織補充說。



