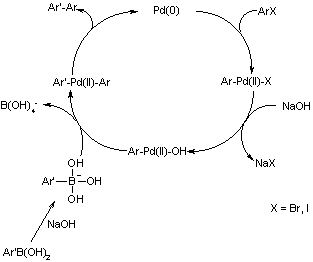
Suzuki反應(鈴木反應),也稱作Suzuki偶聯反應、Suzuki-Miyaura反應(鈴木-宮浦反應),是一個較新的有機偶聯反應,零價鈀配合物催化下,芳基或烯基硼酸或硼酸酯與氯、溴、碘代芳烴或烯烴發生交叉偶聯。該反應由鈴木章在1979年首先報道,在有機合成中的用途很廣,具強的底物適應性及官能團容忍性,常用於合成多烯烴、苯乙烯和聯苯的衍生物,從而應用於眾多天然產物、有機材料的合成中。鈴木章也憑借此貢獻與理查德·赫克、根岸英一共同獲得2010年諾貝爾化學獎。

Buchwald–Hartwig芳胺化反應是非常常用的由芳基鹵代物或芳基磺酸酯製備芳胺的反應。此反應的主要特點是利用催化量的鈀和富電子配體進行催化反應。另外強堿(如叔丁醇鈉)對於催化循環是至關重要的。
3、Heck反應
鈀催化下對烯烴進行烯基或芳基化的反應。另外不含β氫的鹵代烴(主要是鹵化苄)也可發生Heck反應,進行烷基化

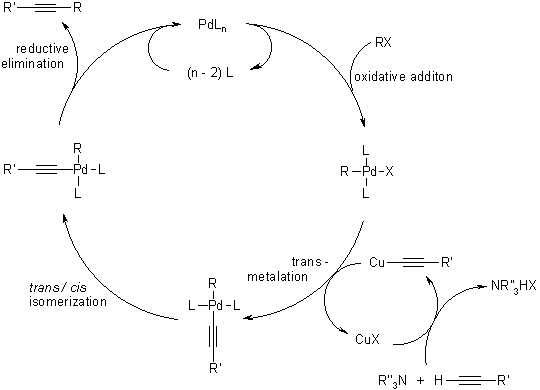
Pd/Cu催化的芳鹵或烯基鹵代物和端基炔進行偶聯的反應。反應機理和Cadiot–Chodkiewicz偶聯與Castro-????Stephens反應類似。Castro-Stephens反應是用化學當量的銅催化,而Sonogashira反應則用催化量的鈀和銅催化。
Stille偶聯反應是指有機錫試劑和鹵代物或類鹵代物在鈀催化下進行CC鍵偶聯的反應。此反應對鹵代物的R基團限製較少。反應的條件比較多,另外正如下方介紹的鹵代物和有機錫試劑種類很多,互相進行偶聯,因此此反應可以合成的產物也很多。本反應的缺點就是,有機錫試劑毒性較大,而且其極性較小,在水中的溶解度很低。雖然有機錫試劑很穩定,但是由於與Stille偶聯幾乎相同的Suzuki 反應的發現,Suzuki 反應使用有機硼酸及其衍生物,使用方便並且沒有有機錫試劑的那些缺點,因此此反應的重要性迅速降低。

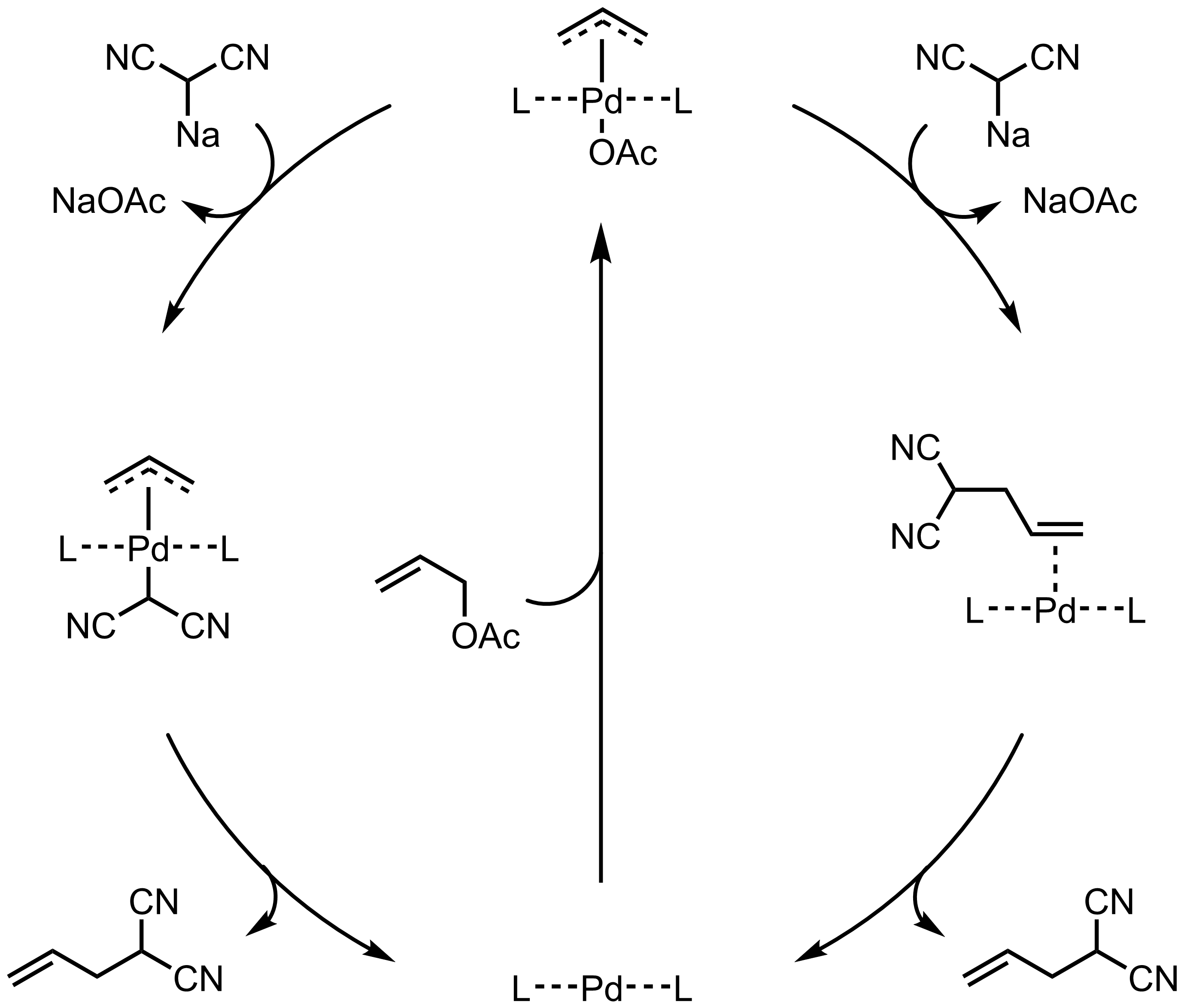
鈀催化下利用烯丙基化合物(如乙酸烯丙酯和烯丙基溴)對親核試劑(如活性亞甲基化合物,烯醇化合物,胺和酚)進行烯丙基化的反應。
Kumada偶聯反應是1972年首先發現的Pd 或 Ni催化的偶聯反應,此反應是格氏試劑和烷基,烯基或芳基鹵代物偶聯的很經濟的反應,缺點是並不是所有的鹵代物都能與有機鎂化合物進行反應。Kumada偶聯在工業上的一個重要應用是合成苯乙烯類衍生物,是低成本合成不對稱的聯芳基化合物的反應。
本反應與Negishi Coupling不同,可以直接和格氏試劑反應,而不需要先轉化為有機鋅試劑。

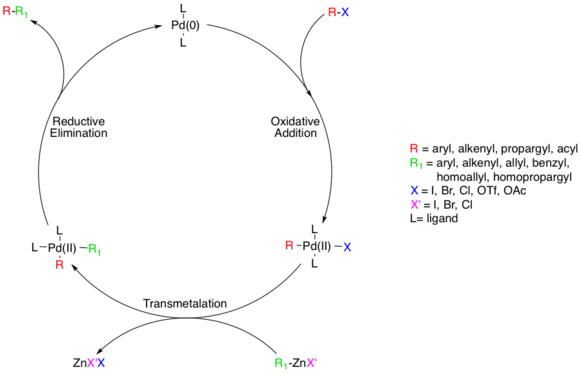
在鎳或鈀催化下有機鋅試劑和各種鹵代物或磺酸酯(芳基,烯基,炔基和酰基)進行交叉偶聯的反應。
反應活性一般比較好、對烷基(sp3) 鋅化合物也能使用,官能團兼容性好。