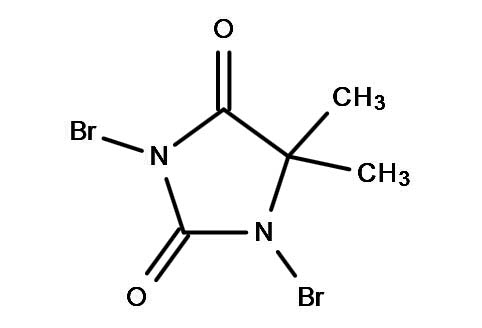
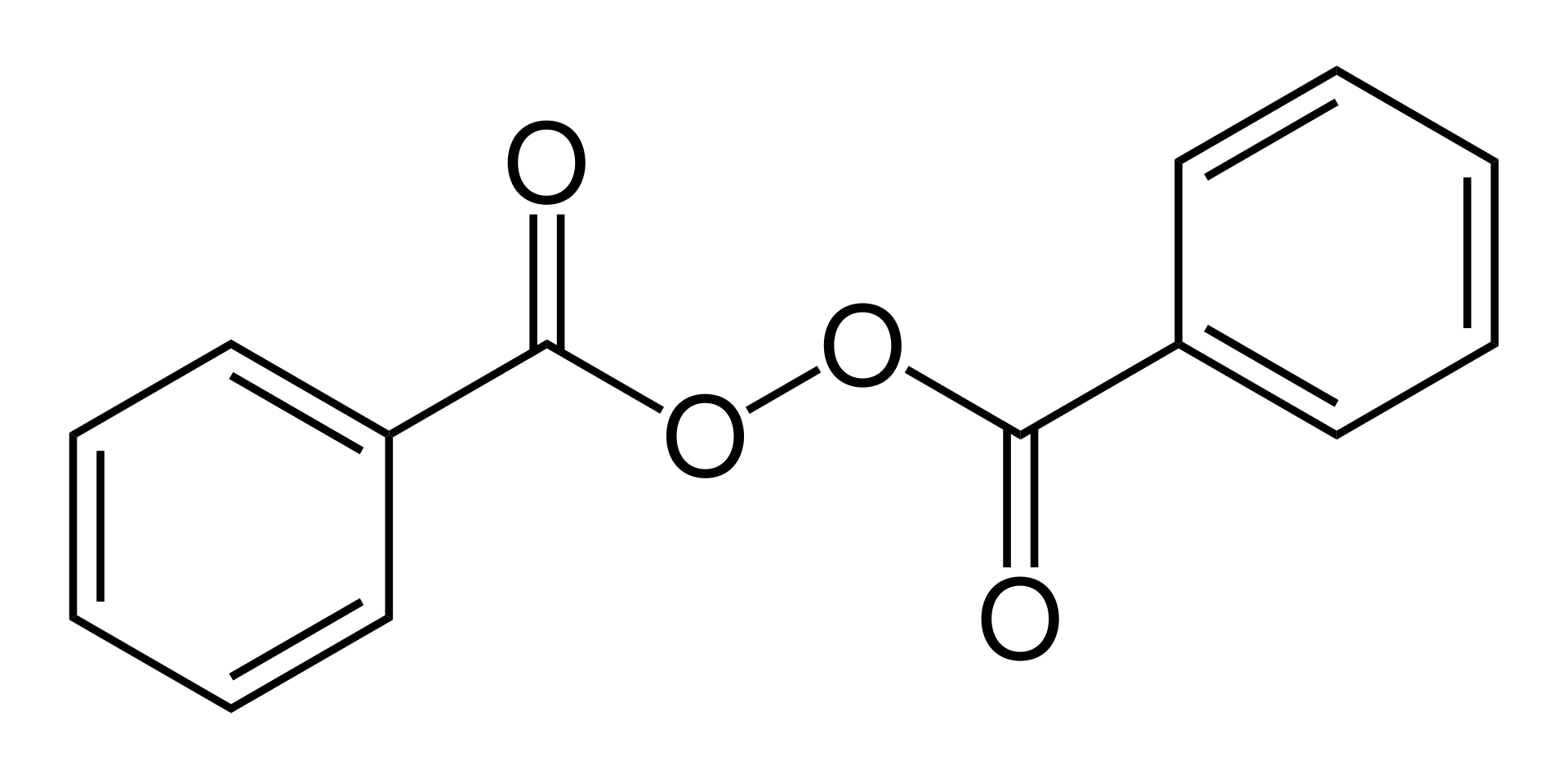
甲基以及烷基(雜)芳香類化合物苄位上溴反應可以說是有機合成化學中最常見的反應類型之一了,反應屬於自由基類型,反應生成的苄溴類合成砌塊,在醫藥研發中應用非常廣泛,可以與各種親核試劑反應,像疊氮化鈉,胺類,苯酚類,硫醇類等等。這類反應通常使用鹵代溶劑,用的最多的是四氯化碳和二氯甲烷,引發劑一般使用BPO(Benzoyl peroxide )和AIBN,溴源用的最多的就是NBS,當然,二溴海因也是可以的。這類反應看似簡單,然而有的時候做的不好,會上兩個溴,形成二溴副產物,你可能會說,那就NBS少加一點,有的時候少加原料反應不完;有的時候,即使少加,也無法避免二溴副產物的生成。當芳環上連有多個烷基或甲基時,情況就更複雜了,就會出現多種排列組合,那麽遇到這種情況怎麽辦呢?今天,小編和大家分享一個非常實用的方法,不管你有幾個甲基,都可以輕鬆化解。
我們先來看一個文獻(Chem. Commun., 2010, 46, 5136–5138)報道的實例,作者設想從化合物1通過自由基反應直接製備化合物3,然而,得到的卻是複雜的混合物。當提高NBS的當量時,反應可以很幹淨地轉化為四溴中間體2,化合物2在DIPEA/HPO(OEt)2條件下以60%的產率得到化合物3,看似多了一步反應,從結果來看,還是很高效的。早在2001年,Jingen Deng 等人(Synthesis 2001, 14, 2078–2080)就報道了類似的合成方法,大家有興趣可以看一看,文中給出的例子比較有代表性,並和其它方法做了對比,彰顯了該方法的實用性。文中指出,HPO(OEt)2搭配非親核堿效果更好,二異丙基乙基胺的效果,明顯好於三乙胺的效果。HPO(OEt)2與DIPEA一般是等比例加料,當量與底物有關,一般是2-8當量不等。除了上述底物,甲基酮上兩個溴,也可以通過類似的方法去掉一個溴,從而得到單溴代酮,這類底物三乙胺相對來說用的比較多。除了上述方法,還有文獻報道實用NaI碘化鈉,同樣可以解決問題,這個小編沒有試過,以後有機會,確實可以試試。
大家肯定會問,反應的機理是什麽呢?小編找了大量的早期的文獻,確實沒有找到,但是根據1983年文獻報道顯示,HPO(OEt)2在堿的作用下,對溴的進攻應該是還原反應的第一步。這個機理同樣在一篇1950年的JOC文獻(JOC,1950,15,637)中找到端倪,如下圖所示。如果大家有知道具體反應機理的文獻,歡迎後台留言分享。