人民日報 於 2022-12-29
北京時間12月29日清晨,《新英格蘭醫學雜誌》(NEJM)發表一項中國產新冠藥物3期隨機對照臨床試驗,其結果表明,對於有高危因素的輕中度新冠成人患者,在至持續臨床康複時間方麵,國產新冠藥物VV116是4天,非劣於輝瑞帕羅韋德(Paxlovid,奈瑪特韋-利托那韋)的5天,兩者的藥物風險比為1.17,且VV116的不良事件更少。
這項試驗由上海瑞金醫院趙任教授、上海仁濟醫院皋源教授和上海瑞金醫院寧光院士牽頭,在瑞金醫院、浦東醫院、上海公衛中心、仁濟醫院、曙光醫院、同仁醫院,華山醫院等7家上海定點收治新冠患者的醫院開展,是奧密克戎變異株流行期間首個針對新冠患者開展的國產口服抗病毒藥物“頭對頭”3期臨床試驗。VV116是由中國科學院上海藥物研究所與武漢病毒研究所、新疆理化技術研究所等單位共同研發的一種新冠病毒RNA複製酶小分子抑製劑。
這是NEJM發表的首個中國自主研發的新冠創新藥臨床試驗,其在今年3-5月的上海疫情極度困難時期高質量完成,尤為難能可貴。記者采訪了相關專家,聽他們講述這款藥的誕生由來,以及這項高難度的臨床試驗是如何完成的。

《新英格蘭醫學雜誌》刊發中國產新冠藥物VB116的3期隨機對照臨床試驗成果
醫學界第一學刊認可國產新冠藥的臨床試驗成果
什麽是“頭對頭”試驗?研究成果在NEJM上發表又意味著什麽?
“頭對頭,就是將臨床上已經使用的治療藥物或治療方法作為對照進行的臨床試驗,可看作是兩種藥物在有效性和安全性上的直接比較。Paxlovid是目前全世界治療新冠的第一藥物,敢於在這個時期拿國產自研的藥物和Paxlovid直接比療效,本身就是一種大膽挑戰和突破。”中科院上海藥物所外籍研究員徐華強解析。
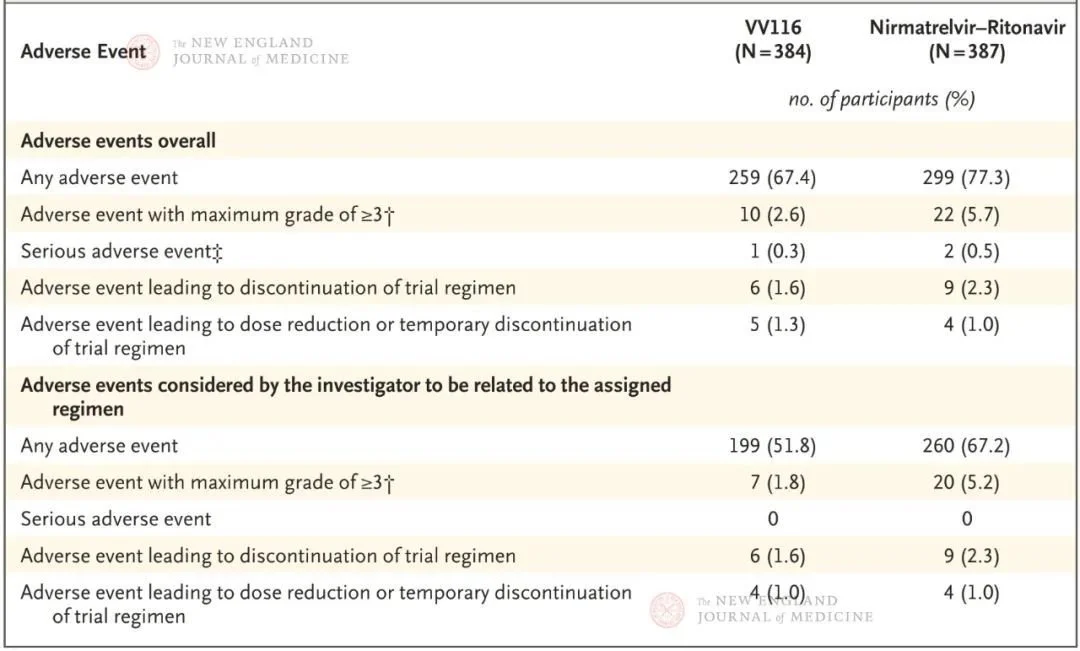
呼吸重症專家、中日醫院呼吸與危重症醫學科主任曹彬教授在解讀這項臨床試驗時指出,VV116和Paxlovid組各招募384和387受試者。受試者中,僅有23.4%未接種新冠疫苗;92.1%屬於新冠輕型患者。結果表明,VV116 組中位症狀恢複時間為4 天,Paxlovid組症狀恢複時間為5天。抗病毒藥物距離發病的使用時間,是影響藥物效果的關鍵因素。發病時間5天內使用抗病毒藥物兩組間無明顯差異。VV116與Paxlovid在臨床症狀恢複時間方麵相當。在新冠病毒(鼻咽拭子)檢測轉陰方麵,兩組也保持了相當的水平。
他認為,在安全性方麵,VV116與Paxlovid也表現出類似良好的安全性,甚至在某些不良反應發生率方麵低於Paxlovid,尤其是味覺障礙。Paxlovid是奈瑪特韋和利托那韋的複合製劑,其中利托那韋因通過肝髒的CYP3A4酶代謝,與眾多藥物存在相互作用。對部分無法停用基礎用藥的患者十分不便。因此,在安全性和用藥方便性方麵,VV116可能更為良好。
VB116的3期隨機對照臨床試驗顯示,兩種藥物在給藥後不良人群對比
那麽,研究成果登上《新英格蘭醫學雜誌》有多難?在美國有近30年科研經曆的徐華強說:“在美國科學界有一種說法,從哈佛大學麻省總醫院走出來的醫生可以獨步天下,作為麻省總醫院創辦的NEJM,是獨一無二的醫學學術第一權威刊物,我們熟悉的《柳葉刀》也隻能排全球第二位。學界一致公認,發Science難、發Nature難,發NEJM是難上加難。”
《新英格蘭醫學雜誌》是由美國麻州醫學協會出版的評審性質醫學期刊和綜合性醫學期刊,創刊於1812年,是全球影響因子最高的醫學學術期刊,世界上每天都有數不清的臨床試驗成果,如此嚴苛挑剔的NEJM為什麽會選中VV116的3期“頭對頭”臨床試驗結果呢?徐華強認為,這充分說明這項試驗研究富有成效、成果有無比珍貴的價值,NEJM的評審都是國際權威醫學專家,絕大部分都不是中國人,他們超越國界,不帶任何的偏見,以科學的目光判定來自中國的研究成果,難能可貴。

瑞金醫院的醫護人員夜間查房,查看昏迷重症病人的瞳孔反射
新藥將有助抗疫
據曾參與VV116臨床前研發工作的徐華強研究員回憶,2020年新冠疫情爆發後,著名藥學家、中科院上海藥物研究所原所長蔣華良院士召集所裏的課題組,請大家把手頭的課題都先放一放,一起攻關這一關乎全世界人民健康的緊急難題。2020年1月19日,中科院上海藥物所成立了抗疫攻關小組,300多位科研人員放棄假期,發揮各自的科研優勢,聯手攻關。
一周後,蔣華良院士與清華大學饒子和院士領導的攻關團隊在全世界率先測定新冠病毒3CL水解酶(Mpro)高分辨率晶體結構,並將這一結構毫無保留地向世界公開。
知道病毒長什麽樣了,下一步就要搞清楚它是如何複製的,如何突破人體的免疫防線,怎樣才能限製它的複製。
“我們在研究中發現,RNA複製酶作為新冠病毒轉錄複製的核心組件,其功能在病毒變異中高度保守,如果能把病毒的RNA複製酶限製住,活性降低了,那麽不管它怎麽變異,都很難在人體內複製、存活。而且,我們發現具有抗病毒活性的核苷類藥物,在抑製新冠RNA複製酶上同樣有效。”徐華強說。
經過46天的日夜奮戰,徐華強團隊成功解析新冠肺炎病毒RNA複製酶單獨結構以及結合RNA和抑製劑瑞德西韋複合物的冷凍電鏡結構,闡述瑞德西韋等核苷類藥物抗病毒的精細機製,該成果2020年5月發表於國際頂刊《科學》上。
上海藥物所沈敬山團隊研究核苷類藥物已經有近20年的時間,徐華強團隊的這一成果為他們送來了重要的作戰線路圖,“相當於把新冠病毒的可能靶標找出來了,把鎖畫出來了,提供給沈敬山老師的團隊去尋找開鎖的鑰匙。”
沈敬山團隊在100多種候選小分子化合物中,夜以繼日地試驗、篩選,終於找到了幾種候選藥物,進而又進行改良,把通常作注射劑狀的藥物改良為口服藥物。“主要是根據新冠病毒攻擊人體上呼吸道、肺部的特點,進行藥物改良。”
據介紹,VV116在體外對新冠病毒原始株和已知突變株都表現出顯著的抗病毒作用;在小鼠模型上,低劑量的VV116就可將肺部病毒滴度降低至檢測限以下,可顯著改善肺組織病理變化,表現出較強的抗病毒功效。臨床前的藥代動力學等研究結果顯示,VV116具有很高的口服生物利用度,其口服吸收後,迅速代謝為母體核苷,並在體內組織廣泛分布。2021年底,VV116在烏茲別克斯坦率先獲批用於新冠治療。
藥理學家、中國工程院院士丁健教授點評VV116時指出,RNA複製酶是抗新冠病毒藥物研發的重要靶標之一,針對此靶標研發的抗新冠病毒藥物不易受病毒變異的影響。臨床前研究和1期臨床研究,已經確證了VV116抗新冠病毒的活性和安全性,該項VV116與Paxlovid口服治療新冠比較的臨床研究,進一步驗證了VV116治療奧密克戎變異株感染患者的有效性和安全性。
丁健教授還表示,抗新冠病毒藥物是有效應對疫情的重要手段之一,尤其是我國在疫情有效防控取得積極重大成果的基礎上,出台二十條優化措施和疫情防控新十條,實施疫情更加科學精準防控,更加需要加強抗新冠藥物的研發、生產和儲備。口服小分子抗新冠病毒藥物具有使用方便、可及性好等方麵的優勢,將在當前和今後疫情防控中發揮重要作用。
醫護人員關心關愛病房中的老人,將他們推送到窗邊感受陽光
疫情重壓下的高標準試驗
臨床前的研發曆盡千辛萬苦,藥物真正進入臨床後又是一道又一道的難關。在VV116孕育誕生的3年裏,蔣華良院士沒有睡過一個安穩覺,他和參與VV116研究的各個團隊、上海各大醫院的專家團隊一輪又一輪地商討方案,就在2022年12月23日他驟然離世的當天上午,他開了兩個小時的線上協調會,籌備VV116藥品上市許可申報事宜。
據瑞金醫院相關研究團隊介紹,這項研究是今年上半年大上海保衛戰中完成的。在今年3月起,瑞金醫院不僅在48小時內完成定點醫院的轉換和陽性感染者的收治,派出21支醫療隊參與各定點醫院和方艙救治,完成核酸檢測等多重任務,更是在繁忙的臨床救治之際,全力以赴、保質保量完成了VV116的三期非劣效性觀察者設盲的隨機對照臨床試驗。
瑞金醫院曆來重視從臨床發現問題、通過科研解決問題、再回到臨床造福病人的轉化研究。尤其2019年轉化醫學國家重大科技基礎設施(上海)投入試運行後,這個5.4萬平方米,設有300張研究型病床的中心,圍繞國家創新戰略和健康中國戰略,已經建設起標準化臨床生物樣本庫、臨床資源深度分析與挖掘平台、生物標記物與藥物研發及新藥創製平台、診斷試劑與儀器開發平台、分子病理與影像技術研究平台和臨床研究型病房六大平台,成功構建了臨床研究、平台運營體係。而基於轉化醫學中心的建設,也形成了與科研機構、研究院所、生物醫藥企等緊密、融合的開放與合作機製。同時,培養出一支優秀的、高效運行的研究團隊。
“入組的新冠病人來自於瑞金北部定點醫院以及瑞金醫院負責運營管理的各大方艙以外,還獲得了上海多個定點醫院和方艙的大力支持。”瑞金醫院副院長趙任介紹,“基於瑞金醫院總院發熱門診和病毒實驗室強大的臨床接診能力和實驗室檢測能力,為VV116臨床試驗對象的順利入組發揮了積極作用。”
“在VV116的臨床試驗中,入組對象主要設定為有症狀且進展風險高的輕中度新冠成人患者,這類患者多數具備基礎疾病,感染新冠病毒後本身基礎疾病有進一步加重的風險,同時服用VV116或對照組藥物後,也可能會有一定的藥物不良反應發生率,這些都需要臨床上密切關注患者病情變化,給予積極有效的救治。”瑞金醫院醫務處長高衛益說,瑞金醫院在定點醫院配置了多層級的診療團隊,包括醫院專家組和由多學科組成的臨床診療組,負責臨床試驗對象的臨床觀察和救治,確保醫療安全。專家組由中華醫學會呼吸病學分會主任委員、瑞金醫院黨委書記瞿介明親自掛帥,帶領院級專家團隊共同“望聞問切”,借助遠程對話、床邊會診可視化係統,指導新冠危重症患者救治。多學科診療組由臨床醫、護、營養、心理等多學科醫護團隊共同組成,兼顧試驗對象的身體照護和人文關懷,幫助他們平穩度過感染期的生理不適,同時緩解焦慮情緒,全程配合順利完成臨床試驗過程。
當時,中國工程院院士、瑞金醫院院長寧光領銜指揮團隊,連續3個多月駐守醫院運管指揮中心,白天進行全院人員、物資、設備、空間等所有醫療資源的統籌調配;每天晚上科研討論如期舉行,每晚8點的VV116臨床試驗進展線上會議雷打不動。
“正是所有同道全力以赴,我們才能順利完成這項研究。”寧光說,“如今中國疫情政策轉向,國門即將打開,我們這項研究不僅為全球抗新冠小分子藥物的研發和臨床應用提供了寶貴的數據和經驗,也將為中國抗疫事業做出貢獻。”
曹彬教授評價,在麵對疫情重大壓力下,仍堅持高標準開展新藥臨床試驗的困難可想而知,我們向所有在疫情期間開展嚴謹科學研究的團隊和受試者及家屬表示敬意,感謝他們為新冠患者診療進步所做的努力,不斷積累可靠循證依據,保障患者的臨床獲益。
(圖片均由上海瑞金醫院提供)
國產新冠藥物試驗結果發布 何時上市PK進口“神藥”?
VV116根據美國吉利德公司抗病毒藥物Remdesivir(瑞德西韋)改造而來。如果最終被證明有效,或可與Paxlovid結合使用。由於它們分別作用於抗新冠病毒的不同機製,理論上將是一個不錯的組合。
撰文 | 淩駿
當地時間12月28日,《新英格蘭醫學雜誌》發布了國產抗新冠病毒藥物VV116的一項Ⅲ期臨床研究結果,發現在因輕、中度新冠感染而住院,且有疾病高風險的成人中,使用 VV116 進行為期 5 天的口服治療,效果並不劣於“新冠明星藥”Paxlovid。
這也是全球權威期刊《新英格蘭醫學雜誌》(NEJM)發表的首個中國自主研發的新冠創新藥臨床試驗。
今日(29日),中日友好醫院呼吸與危重症醫學科曹彬教授在《NEJM醫學前沿》發表評論稱,該研究首次報道了奧密克戎流行情況下,使用VV116和Paxlovid對高危因素的人群症狀改善時間的數據,為後續臨床試驗設計以及臨床用藥指導提供重要參考價值。

本次研究由上海瑞金醫院牽頭開展,招募了2022年4月4日至5月2日上海奧密克戎疫情期間,7家醫院共822名新冠患者,按1:1的比例分配至VV116組和Paxlovid組。
最終,384名和387名分別接受兩種藥物治療的患者被納入分析,中位年齡為53歲,至少具有一項進展為重症新冠感染的高危因素,如 60 歲或以上 (37.7%),高血壓(35.1%)、體重指數BMI>25(32.9%)等。
在研究主要終點——至持續臨床恢複的時間上,相比於Paxlovid,使用VV116達到非劣效應,且VV116組比Paxlovid組的中位恢複時間更短(4天VS 5天)。
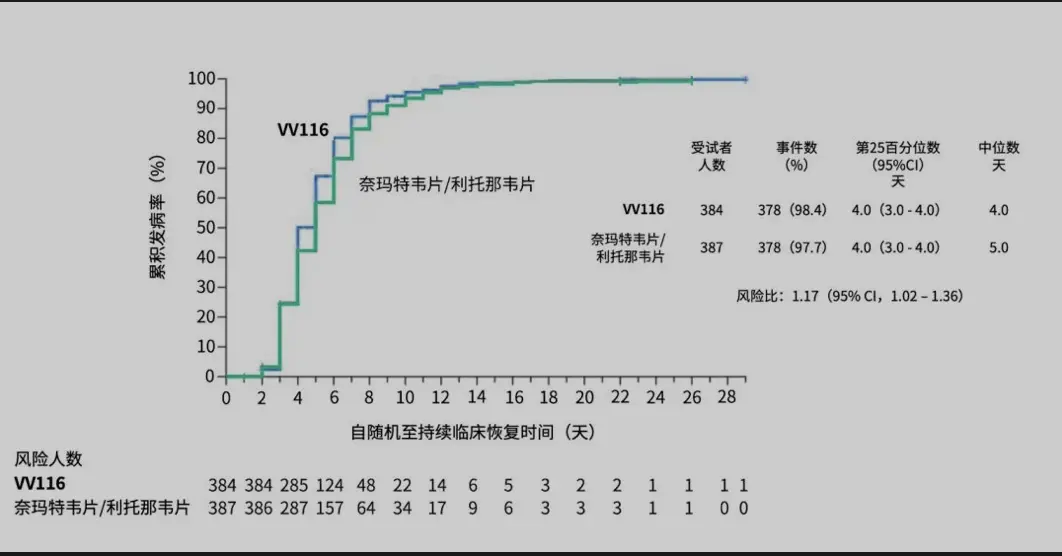
次要療效終點包括截至第28天,進展為重度/危重新冠或全因死亡的患者比例、新冠相關症狀評分、至持續症狀消失的時間、SARS-CoV-2核酸陰性時間等。
VV116組和Paxlovid組在“至持續症狀消失的時間”、“至首次SARS-CoV-2核酸陰性時間”方麵表現類似,中位時間均為7天。在每一個預設時間點(第5、7、10、14、28天),VV116組症狀緩解的患者比例,均高於Paxlovid組。兩組患者均未發生進展為重度/危重COVID-19(新冠)或死亡。
安全性方麵,VV116組報告的不良事件少於Paxlovid組(67.4%對77.3%),3級或4級不良事件也更少(2.6% 對 5.7%)。
美國“錯失的機會”?
VV116是我國首個自研靶向新冠病毒RdRp小分子抑製劑,最初由上海藥物研究所沈敬山團隊根據美國吉利德公司抗病毒藥物Remdesivir(瑞德西韋)改造而來,是Remdesivir體內活性代謝物——GS-441524的結構修飾物。
2021年9月28日,沈敬山教授及相關科研人員發表於Cell Research的文章稱,新冠暴發之初,團隊對各類核苷/核苷酸類似物的抗病毒藥物進行了篩選,發現Remdesivir及其母體核苷GS-441524可以顯著抑製新冠病毒的複製。
Remdesivir具有肝髒靶向性,可肺才是受新冠病毒影響最嚴重的器官,因此團隊選擇了對GS-441524進行結構修飾,提高對新冠病毒的成藥性,最終發現了VV116。
今年7月,美國媒體“Quartz”發文,稱中國開發VV116的故事是美國錯失的機會之一。報道認為,吉利德沒有采取任何行動盡快將GS-441524用於正式的臨床試驗,相反選擇了押寶Remdesivir。
“無論如何,中國做了吉利德不會做的事,押注於GS-441524的功效。圍繞吉利德的專利,中國科學家找到了一種創造性的方法,對GS-441524進行結構修飾,並於2020年4月為VV116 提交了專利申請。結構修飾並沒有從根本上改變 GS-441524 的治療特性,但差異足以避開吉利德的專利範圍。”報道稱。
江蘇開元藥業新藥總監、藥物化學博士胡詩合告訴“醫學界”,VV116突破了原研專利,最終得到的藥效結果良好,說明這項研發工作是成功的。“過程肯定包含了大量結構改造工作,反複嚐試,直到合成、篩選出認為可能是最好的結構。”
胡詩合博士進一步解釋道,Remdesivir真正發揮抗病毒作用的核心結構,是其遊離核苷形式GS-441524,但最初Remdesivir的結構設計是做成肝靶向。
“而VV116結構設計的目標,是口服給藥,將分子遞送入血液循環,進行的結構修飾也提高了其在循環中的穩定性,不易被代謝,長時間保持活性結構並運送到目標,起到抗病毒作用。”胡詩合博士說,“通俗地形容,就是盡可能讓藥物到達靶目標,起到抗病毒作用,因此VV116體內活性強於Remdesivir也很正常。”
除本次《新英格蘭醫學雜誌》發表的Ⅲ期研究,今年5月18日,華山醫院感染科旗下公眾號“華山感染”還發布了VV116針對奧密克戎感染者的首個臨床試驗研究結果,表明在核酸陽性5日內服藥,轉陰時間為8.56天,小於對照組11.13天。
“Quartz”報道認為,若VV116最終被證明有效,或可與Paxlovid結合使用。由於它們分別作用於抗新冠病毒的不同機製,理論上將是一個不錯的組合。
或無法減少重症發生
本次Ⅲ期臨床試驗最初設置了兩個主要終點,分別是患者“轉重症”和“症狀恢複” 的時間,而在試驗中,研究人員放棄了“雙終點”,僅探索了患者的持續症狀恢複時間,此前這一改變也引發了一定的爭議。
對此,曹彬教授在前述評論中分析,可能是因為試驗執行過程中發現奧密克戎致病性下降,導致重症事件發生概率極低,研究人員隻能放棄“重症”這一實驗指標。而也正如預期,結果表明兩組(VV116和Paxlovid)進展為重型的受試者人數為0。
“從目前情況來看,靶向減少重症發生這一適應症已經基本不可能完成,針對新冠門診輕症患者的症狀改善適應症,是目前尚未被滿足的臨床需求。”曹彬寫道。
評論分析,麵對迅猛發展的新冠疫情,我國亟需高效抗新冠病毒藥物。盡管輝瑞公司的Paxlovid(奈瑪特韋-利托那韋)和國產原研藥阿茲夫定早已獲得應急附條件批準,但或由於供應不足等原因,還遠不能滿足臨床需求。
據“21財經”報道,《新英格蘭醫學雜誌》發文後,君實生物A股、H股均漲超10%,君實生物投資關係部門相關人士稱,目前VV116還未提交上市申請,跟藥監部門保持持續溝通。“目前監管部門認為還需要更多的數據支持,所以還不支持我們用這個三期臨床研究去提交上市申請。”該人士表示。
醫學界查閱“clinicaltrials.gov”網站後發現,VV116還在進行兩項Ⅲ期臨床,規模分別為1200人和1310人,均為多中心、雙盲、隨機、安慰劑對照研究,目前正處於招募階段。

“不用剩下兩個結果都出來,至少出來一個,我們就會盡快啟動溝通了。”前述人士表示,至於何時獲批無法預測,我們肯定希望越早越好,但是獲批完全取決於監管。
而除VV116外,目前我國外也還有多款新冠治療藥的研發和上市在加速推進之中。
12月26日,江蘇省藥品監督管理局官方微信號發布消息,先聲藥業SIM0417Ⅲ期臨床已完成全部1208例患者入組,進度處於國內新冠3CL靶點治療藥物第一位,最快於明年2月上市。
另據報道,深圳市第三人民醫院臨床試驗中心發布通知,眾生藥業、武漢生物製品研究所、科興製藥也在近期進行陽性患者的招募。三款藥物分別為RAY1216片、F61注射液和shen26膠囊。