朱頭山
無意邀眾賞,一心追殘陽上周寫了《阿茲海默症與藥物》一文,在博客和論壇欄目總共收獲近八千人次的點擊。對此深受鼓舞,接著寫阿茲海默症與藥物的第二篇,關於阿茲海默症病因的第二個假說:tau蛋白假說。
根據著名教科書《分子細胞生物學》[1]第1026頁第22章“神經係統的細胞”中介紹:成年人的大腦重1.3千克,是存儲、計算、整合和傳輸信息的控製中心,包含近1000億個神經細胞,稱為神經元(neurons)。這些神經元通過大約1000兆(萬億)個突觸(synapses)相互連接,突觸是兩個或多個神經元進行通信的連接點。單個神經元可以與多達1萬個其他神經元經突觸連接。

上圖中細胞體周圍有神經突,包含周邊的樹突(Dendrites)和圓圈中的軸突(Axon)。軸突中有細胞骨架叫微管(Microtubule)。兩種微管蛋白分別是450至500個氨基酸組成的線團 - 球狀微管蛋白,它倆分別叫 α 和 β 型微管蛋白(tubulin),再聚合成管狀原絲(protofilaments - PFs),見下圖。

微管受外麵的微管相關蛋白(Microtubules-associated proteins - MAP)調節。微管相關蛋白包括對神經元生長和功能至關重要的典型蛋白,如tau和MAP-2、MAP-4或MAP-6等。tau占神經元微管相關蛋白總數的80%以上,穩定並束縛著軸突微管[2]。
tau 蛋白
前麵說了tau蛋白是一種軸突蛋白-微管相關蛋白,可穩定並捆紮微管。tau 蛋白有六種不同的異構體,從 352 至 441 個氨基酸殘基長短不齊。下圖的左半部是一種tau蛋白(細線)連接在α和β型微管蛋白(小球)上的示意圖[2]。有tau蛋白的連接,微管就不會散架。

正常時 tau 蛋白的含有幾種氨基酸會在蛋白激酶的作用下磷酸化。但異常或過度的磷酸化會使tau蛋白彎曲-折疊、脫落、互相粘連和抱團等。見上圖的右半部。tau 的粘連和抱團形成神經元纖維纏結(Neurofibrillary tangles - NFTs),NFT 均由不溶性密集填充的蛋白絲構成。
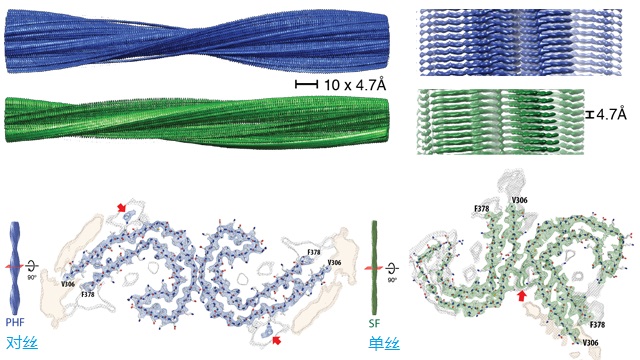
脫落的tau蛋白可以互相粘連並疊成絲,一種是成對的螺旋絲(paired helical filaments)-藍色和直的絲(straight filaments)-綠色[3]。兩者組成成分相同,隻不過蛋白互聯的地方不同,見下圖。這些絲抱團形成神經元纖維纏結,最終導致癡呆症。見前文《阿茲海默症與藥物》的圖一
tau 蛋白除了出現上述的錯誤折疊外還可能出現其它位置的錯誤折疊,如下圖左半部的折疊會引起皮克氏(Pick's)病,也一種漸進性癡呆;右側(同上圖)的折疊引起阿茲海默病。同樣是tau 蛋白折疊出不同,引發的病不同,但同樣是癡呆。
基於tau療法的藥物
1,調節tau磷酸化:tau蛋白的過度磷酸化很可能是多種蛋白激酶活性的結果,減少病理性tau蛋白磷酸化的更有效靶點是特定的激酶還是不同蛋白激酶(如GSK-3β,MARK和CDK5,見下圖)組合作用仍然是未知。當然,臨床上最先進的蛋白激酶抑製策略是針對GSK-3β。但現有的臨床試驗還沒有成功的例子。

2,針對其它tau翻譯後修改:除磷酸化外,tau還被賴氨酸乙酰化廣泛地翻譯後修飾,這導致tau功能受損並促成病理性聚集,所以人們提出使用tau乙酰化抑製劑作為AD和其他Tau蛋白異常沉積(Tauopathies)的潛在治療策略。但還沒有有效的化合物。
3,微管穩定劑:tau蛋白與微管分離會導致其正常的微管穩定功能喪失,並最終導致軸突運輸缺陷和突觸功能障礙。一些動物試驗表明一種紫杉醇小分子有穩定微管的功效。但臨床試驗失敗。
4,tau蛋白聚集抑製劑:體外和/或基於細胞的篩選測定已找到幾種能夠抑製tau聚集有功效的小分子化學物係列。但在很大程度上缺乏在體內抑製tau聚集和明顯改善認知的功效的證據。
TauRx公司的LMTX是一種穩定的無水還原形式的甲基硫代氯化鎳,可以用作tau蛋白聚集抑製劑。2018年12月美國食品和藥物管理局(FDA)已授予LMTX的孤兒藥指定(ODD),用於阿茲海默病額顳癡呆(FTD)亞型的治療,還沒有被批準上市。
FDA僅授予用於治療、診斷或預防在美國影響少於20萬人或影響超過20萬人但預計不會收回開發和營銷成本的罕見疾病或病症的藥物為ODD資格治療藥物。ODD用於鼓勵讚助商開發罕見病產品。ODD藥物有七年市場獨占權。
5,抗tau主動免疫療法:基於引起能夠清除tau蛋白的特異性抗體反應,一些生物抗tau免疫療法的方法已在動物模型中成功測試,表明這可能是清除Tau蛋白異常沉積的方法。
AADvac1是第一個旨在修飾tau蛋白來治愈阿茨海默氏病的活性蛋白疫苗,正在臨床試驗。
Gosuranemab(BIIB092)IgG4單克隆抗體,正在二期臨床。
Genentech 的(RO7105705)IgG4單克隆抗體,正在二期臨床。
Zagotenemab(LY3303560)單克隆抗體,2021年完成二期臨床。

tau的臨床診斷
顯而易見為了區分不同類型的阿茲海默病要用不同的造影劑來做PET。研究人員已經篩選了數百種氟同位素化合物。有些方法正在做臨床試驗。
例如:比較新一代放射性正電子發射斷層掃描(PET)示蹤化合物氟18RO-948和MK-6240的臨床試驗工作(NCT03939780)計劃在2023年得到最終結論。

科學家們以經有很多科研成果,但關於由tau蛋白引發阿茲海默病的假說及其發病機理和治療藥物的研究好像不是“指日可待”而是“任重道遠”,我們隻能“翹首以盼”。
阿茲海默病還有其它假說和防治藥物嗎?有沒有“野路子”?
待續...
[1] Harvey Lodish et al. Molecular Cell Biology. W. H. Freeman and Company. ISBN: 978-1-4641-8339-3.
[2] Elizabeth H. Kellogg et al. Near-atomic model of microtubule-tau interactions. Science. 2018 June 15; 360(6394): 1242–1246. doi:10.1126/science.aat1780.
[3] Anthony W. P. Fitzpatrick. Cryo-EM structures of tau filaments from Alzheimer’s disease. Nature 547, 185–190 (2017). doi:10.1038/nature23002




