本文轉自微信公眾號:老和山下的小學僧(ID:gh_586564bb7b66),封麵:unsplash
我們離癌症有多遠?
國家癌症中心數據顯示,一個人從40歲開始,患癌概率顯著上升,活到74歲,累積患癌率21%,活到85歲,累積患癌率36%。可以說,如果一個人沒有因其他原因死亡,那麽到頭來有三分之一的可能就是癌症。

這有多可怕?一家三口加雙方父母共7口人,終其一生,7人全都不患癌症的概率是4.4%,雙方父母四人,活到74歲全都不患癌症的概率是39%。如果再把親戚朋友算上,幾乎沒有多少家庭能躲開癌症。
我們與癌症近在咫尺!
所以,了解癌症很有必要,最大的致癌因素是什麽?估計你八成會猜錯。
了解癌症有哪些渠道?肯定不是商家醫院的廣告。
治療癌症有哪些方法?大多數人的認知停留在二十年前。
哪些癌症已經能治愈?你可能認為這是天方夜譚。
不急,從頭說起。
不靠譜的化學反應
癌症來自基因突變,即DNA出錯。在最理想狀況下,DNA複製轉錄出錯的概率是十億分之一,這是人體衰敗的主因,也是人類進化的根源。
這十億分之一的概率能不能消除?
從硬件上說,人體的本質是一堆化學反應,化學反應的本質是原子外層電子的相互作用,量子力學告訴我們,電子的本質是個不靠譜的家夥,它的行為隻能用概率描述。因此,要把化學反應的出錯率降到零,是不可能的。
這十億分之一的概率會不會增加?
影響化學反應實在是一件很容易的事情,但凡能引起DNA出錯的東西,都叫致癌物。判斷一個東西是否致癌並不輕鬆,除了那些權威機構公布的不知有多少可信度的致癌物清單之外,我們不妨從癌症統計數據中再找些規律。
推薦國家癌症中心每年發布的全國癌症統計報告,值得專門撰文解讀,不過咱這兒就簡單從2019年1月發布的報告裏摘幾個結論:
-
城市發病率高於農村
-
農村死亡率高於城市
-
城市農村癌症種類差異明顯
-
男性發病率排第一,肺癌
-
女性發病率排第一,乳腺癌
-
男女死亡率排第一,肺癌
該注意啥,心裏有點數了沒?像醫學養生這類知識,對於外行來說,去看微觀研究,不如看宏觀統計。這份報告蘊藏的信息量非常大,建議全篇背誦。
還有一份美國癌症學會出的全球癌症統計報告,學術價值更大一點,建議全篇略讀。不過,這裏有個結論估計能讓人大跌眼鏡。
你猜猜,全球癌症發病率最高的國家都有哪些?丹麥、挪威、法國、新西蘭、比利時……一水兒的發達國家,而中國的癌症發病率遠低於日本德國,沒想到吧?
這是為何?原因無他,就是活得太長了,人均壽命排行榜和癌症發病率排行榜如出一轍。雖然有些窮國家的統計很粗糙,但不影響這個基本結論。
當然也有例外,日本人均壽命排第一,但癌症發病率隻有40名左右;美國人均壽命第30-40名,但癌症發病率有望殺入十強;中國人均壽命大約50名,癌症發病率大約80名。不過,咱這兩個排名都在顯著增加,不知是該高興還是悲傷……
媒體老是拿“癌症發病率上升”這事來證明環境汙染越來越嚴重,但搞笑的是,這其實是邁向發達國家的標誌。根據國家癌症中心的結論,中國癌症發病率的增加主要由壽命增加引起,標化發病率水平基本持平,同一年齡段的癌症發病率並沒有增加。
以上內容都是引用,別和我爭,下麵才是個人觀點:人均壽命和癌症發病率相結合,可以作為食品安全與環境汙染的評價指標,這方麵,中國比預想中好很多,至少沒有繼續惡化,甚至還有好轉的趨勢,或許還能媲美普通發達國家。
癌症死亡率則是評價整體醫療水平的關鍵指標,這方麵,中國與發達國家差距甚大,60%的癌症患者活不過5年,而發達國家的這一數據隻有20%-40%,十年前的中國是70%。
細胞涅槃
回到微觀,癌症到底是個什麽東西?
人體大約50萬億個細胞,都從一個受精卵分裂而來。受精卵在剛開始階段,一分二、二分四、四分八……這德性和癌細胞沒什麽兩樣。

斑馬魚受精卵分裂過程,視頻時長20小時
但從某個時間開始,這種無限分裂的開關被關了,細胞分化出不同類型,神經細胞、皮膚細胞、肌肉細胞等等,這些細胞有個共同點,壽命一到就得死亡(暫不論生殖細胞)。
操縱這一切的,就是基因。
基因不斷突變,隻要湊巧把這個開關打開了,細胞就會重啟無限分裂的技能,這種細胞其實和正常細胞差別不大,隻是它沒有壽命限製,會無限分裂,最終靠數量把人體壓垮。
說到底,癌細胞就是追求長生不老的正常細胞,並且它成功了。
不過暫時還不用怕,咱有免疫係統。
癌細胞出現後,會和免疫係統上演一場“適者生存”的戲碼。其實正常人每天都會產生不少癌細胞,畢竟咱有十億分之一的突變概率嘛,隻不過它們都會被免疫係統清除。各位,給免疫係統的功勞簿上再記一筆吧!

T細胞殺死癌細胞,視頻時長40分鍾
但免疫係統並不是一塊鐵板,漏洞也就比篩子少一點,無數前仆後繼的癌細胞,隻要撞上了漏洞,就能發展成癌症,所以癌症種類非常多。
這還沒完,能躲過免疫係統追殺的癌細胞,基因突變概率往往特別高,從十億分之一提高到百萬分之一也是等閑。於是,更快的分裂速度,更高的突變概率,使得癌細胞進化速度暴增,不但把免疫係統打成了篩子,對藥物也具備很強的抵抗力。
更恐怖的是,癌細胞還能進化出組織能力,可以派偵察兵尋找好地方並潛伏下來,一旦主基地被毀,就可以發展第二基地。
操縱這一切的,也是基因。
把癌細胞在人體內的演化,看成生命在地球上的演化,就不會驚訝於癌細胞表現得像智慧生物。
對我們人來說,每次基因突變,就是一場賭局,隻要賭的時間足夠長,總有輸的一天。俗話說得好,哥來到這個世界上,就沒打算活著回去。
癌症能根治嗎?
抬個杠,什麽叫治療?
仍以感冒為例。感冒由病毒引起,治療就是殺病毒,病毒是被免疫係統殺死的。那麽問題來了,協助免疫係統更快更好地殺病毒,算不算治療?比如喝水,比如吃飯,又或者是某些特殊的尚不明確的化學物質,比如中藥。這個話題放一邊。
再抬個杠,什麽叫根治?
如果把癌細胞殺的一個不剩叫根治,那就別想了,即便正常人每天都會產生癌細胞。如果把發展成癌症的那類癌細胞殺光了叫根治,那也很麻煩,因為癌細胞一直在變異,你甚至都分不清,新癌細胞是從正常細胞變異來的,還是從老癌細胞變異來的。如果癌症治愈後10年再得癌症,10年前那次治療算根治嗎?
不抬杠了,癌症一般不叫根治,而叫:5年生存率。
患者在治療後,即便用最先進的檢測技術證明所有參數都正常了,醫生也不敢說根治,至少要等一段時間再說,要等多久呢?
5年!
這個5年有什麽深刻機理嗎?不好意思,隻是個統計數據而已:3年不複發,80%的可能是治愈了;5年不複發,90%的可能是治愈了;抱歉,這個世界沒有100%的事情。
一般認為,患者在5年內沒有複發,就算治愈了。

中學生物知識複習的差不多了,下麵說些作為一個成年人應該知道的東西。
本僧先把個人觀點亮這兒:把人類與癌症的對抗看成一場持久戰的話,現在至少是戰略相持階段。人類的抗爭,已經從小米加步槍的戰鬥,一路成長到海陸空天全方位的高科技戰爭。
這是一部精彩絕倫的戰爭大片!
無差別攻擊
大多數人對癌症的印象就是:切除+放療/化療,然後等死。
這顯然是極大的誤解,放化療對人體細胞算是無差別攻擊,雖是無奈之舉,但也沒有那麽不堪。
普通戰鬥
如果癌細胞沒有擴散,而且長在能切的部位,那麽切除確實是最好的辦法,治愈率非常高,說十拿九穩也不誇張。
老生常談:治療癌症,早發現最重要。
但是,癌細胞組織特別鬆散,很容易脫落,若遇到庸醫,把腫瘤弄破了,哪怕隻是逃出去幾個癌細胞,很可能就會東山再起。1克的腫瘤團塊,就有10億個癌細胞,掉下一丁點,妥妥就少半條命。
最麻煩的是,目前任何技術,都無法檢測出體內殘存的少量癌細胞,更分不出這是手術後殘留的,還是手術前擴散的,都得等上三五年再說。因此,找個好醫生動刀很有必要。
這兒又有一個讓你意向不到的事情:單就手術開刀這個環節,中國醫生的水平是全球頂級的,原因無他,唯手熟爾。
對中國醫生來說,日均1例手術都不叫個事,一年手術量夠國外醫生做一輩子了。

手術量大的醫院,手藝都不會太差
局部戰役
如果沒法手術或者擔心手術後有殘留,並且癌細胞禍害的區域仍在局部,就可以考慮放療(化學藥物治療叫化療,放射性治療叫放療)。
傳統放療一般用伽馬射線之類的,這玩意兒簡直就是機槍掃射,不管好人壞人,雞犬不留,而且放射線本身也是一種致癌物,會增加正常DNA出錯的概率,副作用賊大。
為了減少副作用,最近幾年科學家正在嚐試用質子束進行放療,就是所謂的“質子療法”,也是放療的一種。
雖然這技術前景尚不明朗,目前也沒有表現出更出色的療效,但就是貴,原因你懂的。
全麵戰爭
如果癌細胞擴散全身或者白血病這類非實體腫瘤,通常就得化療。
用化學藥治療的邏輯是,先找到癌細胞和正常細胞的區別,再開發相應的化學藥物。但癌細胞源自正常細胞,兩者差別不大,早些年,科學家隻知道癌細胞比正常細胞分裂速度更快。無奈,隻能拿這個做文章。
早期的化療藥不管正常細胞和癌細胞,隻是粗暴地抑製所有細胞的分裂速度。這下就炸鍋了,看看正常細胞的更新周期:腸細胞2-5天,皮膚細胞28天,白細胞2-3周,紅細胞4個月,肝細胞5個月……隻有神經細胞、心肌細胞等少數細胞是一輩子不更新的。
化療藥這麽蠻幹,雖然對抑製癌細胞很有效,但也對人體產生了係統性的負麵影響!最顯眼的就是,分裂旺盛的頭發被長期抑製後,患者大多成了光頭。
可即便是“兩害相權取其輕”的妥協方案,依然耗費了無數人的心血。

認識這植物嘛?太平洋紫杉,紅豆杉的一種,從紫衫樹皮中提取的“紫杉醇”,號稱抗癌第一藥。科學家花了20年,測試了3萬個樣本,才找到這個迄今為止最優秀的天然抗癌藥。
了解其抗癌原理要懂些高中生物知識,簡單來說,紫杉醇會讓微管蛋白聚成一團,抑製紡錘體形成,破壞有絲分裂,導致細胞分裂卡在DNA合成後期無法繼續。
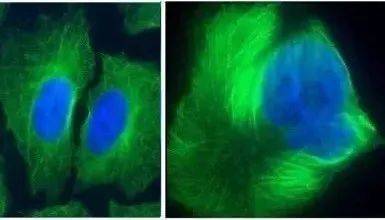
左邊細胞順利分裂成2個,右邊微管蛋白被紫杉醇攪成一團,細胞分裂被凍結。
紫杉醇一經問世便療效斐然,甚至對複發性卵巢癌的有效率都達到了30%!這在上世紀80年代是爆炸性事件,要不是環保組織攔著,紫衫差點被砍到絕種。(認真點,這不是玩笑!)
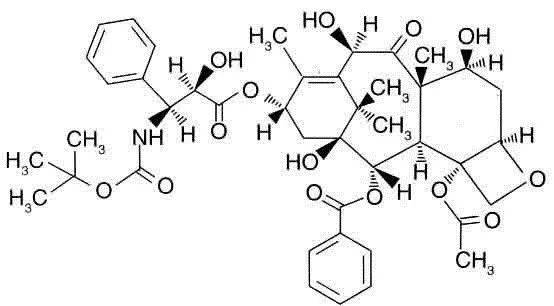
到底是什麽化學物質如此神奇?來,給你看一眼:

這兒有個嚴肅的事情,很多人不問原理,隻聽說紅豆杉能抗癌,就把它當成防癌補品來用。如果抗癌和防癌是一回事,那子彈就可以當防彈衣用了。當他們知道紫杉醇是抑製細胞分裂的化療藥,正常人吃了和吃毒藥差不多的時候,不知道是個啥表情?

順便捅一下馬蜂窩,你說,這玩意兒算中藥嗎?算中藥治療癌症的例證嗎?
如果還嫌不夠熱鬧的話,再捅幾下:從秋水仙提取的秋水仙堿,從長春花提取的長春花堿,從美登木提取的美登木素,都是通過抑製微管蛋白的聚合(紫杉醇是讓微管蛋白過分聚合),破壞紡錘體成形,最終讓細胞分裂停止。
雖然長春花、美登木很早就是一味藥材了,在傳統醫學裏使用頗多,但發現其抗癌成分的是美國人和加拿大人。從確定療效到確定成分,再到提純,再到人工合成,再到改進配方,所費心血不知凡幾。
舉個例子,法國科學家Potier在用10-DAB合成紫杉醇的過程中,發現一個中間產物叫RP5676,比紫杉醇更能結合微管蛋白,後來這個中間產物就成了新的抗癌藥:多西他賽。
不說中藥話題了,本僧怕外行的口水。
手術、放療、化療是癌症治療三大利器,三者往往結合使用,有些局部治療也用化療,有些全身治療也用放療。雖然是無差別攻擊,但隻要治療得當,三大利器對付癌症還是很有效的。
不過癌症治療是極其複雜的工作,不然IBM花了幾百億的Watson係統也不會铩羽而歸,所以沒法指望每個醫生都能製定完美的治療方案。
治療得當是幸運,治療失當也不稀奇。
心理戰
信息時代的壞處是人人都知道放療化療的副作用,這種心理暗示在治療過程中造成的傷害不容小覷。如果再遇到一個庸醫,那治療就和催命沒啥區別了!
原本免疫係統在和癌細胞的攻防戰中還能勉強維持,放化療一頓瞎搞,殺敵八百自損一千。可人家癌細胞恢複力強啊,等它們緩過勁發動第二波攻勢,就剩摧枯拉朽了。
聽過很多醫生感慨說:癌症死亡有三分之一是被嚇死的,還有三分之一是治療不當,最後三分之一才是真正無力回天。當然,感慨隻是感慨,當不得真。
再一句老生常談:好心態和好醫生同樣重要!
小結:作為一個合格的成年人,應該要知道,大部分早期癌症完全可以通過手術治愈;情況稍微嚴重點,加上放化療還是能輕鬆控製,甚至治愈;隻有嚴重的癌症,才不得不聽天由命。
精確打擊
幸運的是,到了21世紀,癌症治療開始不再是簡單粗暴的無差別攻擊,而是尋找癌細胞和正常細胞之間更多的不同點,這就是“靶向藥”的概念。
讓我們通過人類第一個靶向藥的研發,來領略一下科技的風采吧!
1959年美國費城有2位研究員,意外發現慢粒白血病患者的22號染色體特別短小,這一發現衝擊了“癌症由病毒引起”的主流觀點,醫學界立馬沸騰了。
22號染色體消失的部分去了哪裏?13年後,芝加哥的科學家發現了慢粒白血病患者另一條異常染色體:9號染色體變長了。
到了這會,就是我們這些外行也能猜到:兩條染色體斷裂後形成易位,22號染色體的長臂,跑到了9號染色體上。科學家很快證實了這一點,並稱之為費城染色體。

倆染色體易位有什麽後果?又過了13年,科學家發現,9號染色體斷點的ABL基因編碼是一種促進細胞分裂的激酶,這種激酶是保證正常細胞分裂所需的,活性會受到嚴格控製。但ABL基因和22號染色體斷點的BCR基因結合之後,使得激酶像電腦程序卡死一樣,始終處於高活性狀態,導致細胞分裂失控,最終引起癌症。
科學家給這個發瘋的激酶取了個名字,BCR-ABL蛋白。隻要把BCR-ABL注入小白鼠體內,小白鼠就會有白血病症狀。經過反複實驗,最終證實,BCR-ABL正是造成慢性粒細胞白血病的原因。
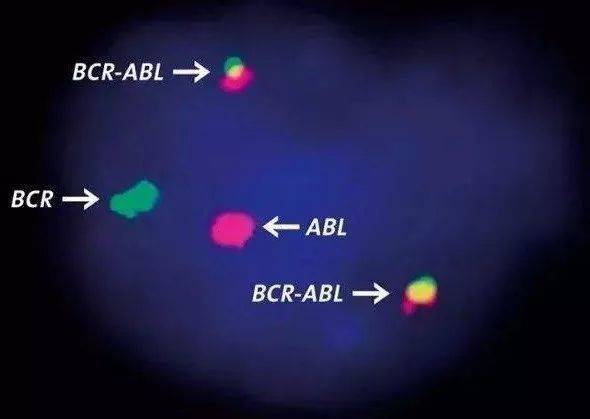
靶子終於找到了,接著就是打靶了。
醫藥公司這個時候才會介入,開始燒錢研發,可即便如此,也足足燒了15年,研究人員不斷設計和修飾藥物分子,最終開發出4-[(4-甲基-1-呱嗪)甲基]-N-[4-甲基-3-[[4-(3-吡啶)-2-嘧啶]氨基]苯基] -苯胺甲磺酸鹽,光看名字就知道開發這玩意兒有多難了!
這種全新的化學成分學名甲磺酸伊馬替尼,商品名:格列衛。它可以抑製BCR-ABL蛋白的活性點,對慢粒白血病有奇跡般的效果,而正常細胞沒有這種蛋白,所以副作用非常有限。
有趣的是,這玩意兒不像紫杉醇是“純天然提取的綠色產品”,而是人為設計並合成的新化學成分。但論副作用,能把純天然的紫杉醇甩開幾條街。本僧多嘴一句,純天然和健康完全是兩碼事,本質還是要看裏麵的化學反應,別忘了,古代毒藥基本都是純天然的。
格列衛於2001年5月通過FDA批準,整個審批過程不到三個月,創造了FDA審批藥物的最快記錄,並評為當年的十大科技突破,是人類抗癌曆史的裏程碑。
格列衛憑借一己之力,將原本是絕症的慢粒白血病變成了類似高血壓這樣的慢性病,五年生存率超過90%!隻要定期吃藥,日常生活和普通人沒兩樣,壽命也有保障,是目前最成功的靶向藥。
更為欣喜的是,格列衛雖然不能直接讓錯位的染色體恢複正常,但給了人體係統充足的備戰時間,最終大約有30%-40%患者的費城染色體轉為陰性。

捋一下思路:發現癌細胞機理—人為設計藥物分子—解決癌症,這套路看著無比痛快,但想到研發投入就無比痛心了!若是有些捷徑,自然不應客氣。
急性早幼粒細胞白血病,17號染色體和15號染色體易位,17號染色體上的RARα基因與15號染色體的PML基因形成PML-RARα融合基因,導致早幼粒細胞分裂不受控製,引發白血病。
這曾是一種極為凶險的白血病,幾個月便可奪人性命!但現在用全反式維甲酸和三氧化二砷(砒霜)進行聯合靶向治療,五年生存率已超過90%,達到基本“治愈”標準。
這一治療方案的靈感來源於一個民間中醫的偏方,後來科學家從分子機理上揭示了誘導白血病細胞分化凋亡的過程,把療效隨緣的偏方升級成十拿九穩的抗癌藥,中國前衛生部部長陳竺是這一成果的重要貢獻者。

靶點
打蛇打七寸,慢粒白血病的BCR-ABL,急性早幼粒白血病的PML-RARα,就是癌細胞的七寸,醫學上稱之為“靶點”。隻要找到了靶點,人類就很有希望製服癌症這條毒蛇。
但並非每一個靶向藥都有格列衛這般神奇,或者說,幾乎沒有什麽靶向藥能全麵超越格列衛。一般靶向藥能把晚期五年生存率提高到30%就算很優秀了,因為其他癌細胞並沒有像BCR-ABL這麽容易搞定的特征靶點。
那咋辦?科學家很快搬出了新武器。
美國科學家從癌細胞分泌物裏發現了血管內皮生長因子VEGF,這是一種可以促進血管形成的蛋白。要知道,癌細胞的高效分裂是以消耗大量營養為代價的,而營養靠血管運送,所以腫瘤為了保證營養,會瘋狂促進周邊血管的生長。
於是,科學家提出了一種針對腫瘤血管,而不是針對癌細胞的治療思路,靶點正是VEGF。
2004年美國FDA批準了第一個抗腫瘤血管生成藥物,安維汀。它可以阻止VEGF與血管內皮細胞結合,抑製血管形成,大幅度削減了腫瘤的營養供應,從而抑製腫瘤生長和擴散轉移,延長患者壽命。
不過,癌細胞勒緊褲腰帶,日子還是能過的,有啥辦法能徹底“餓死”癌細胞?
2018年1月《自然》的一篇文章讓我們看到了希望,科學家發現了一種可以控製細胞內脂肪合成和營養物質循環再生的蛋白:REV-ERB。如果REV-ERB維持在較低水平,細胞就會允許合成脂肪並且把一些廢棄的營養物質循環再生,如果REV-ERB的水平升高,細胞就會停止那些工作。這是一個正常操作,和人體生物鍾有關。
癌細胞因為要合成營養,就得把REV-ERB的活性降到很低。科學家嚐試激活了這個蛋白,結果發現,大量癌細胞真的被餓死了!更驚喜的是,正常細胞的REV-ERB活躍度本身就很高,所以在治療過程中基本不受影響。
簡單來說,癌細胞每天要吃10碗飯,正常細胞每天隻吃1碗飯,科學家想辦法把米飯供應降到了1碗,於是,癌細胞餓死了。哎,吃貨到了哪裏都不容易啊!
可惜,針對REV-ERB靶點的研究尚未成熟,靶向藥更是無從談起。

我猜你肯定很想知道,人類已經找到了多少靶點?又有多少已經開發出了靶向藥?熱愛祖國的同學可能還會多問一句:咱們國家做了多少貢獻?
截止2018年底,從FDA批準的靶向藥來看,已經開發出靶向藥的靶點有:肺癌12個,乳腺癌6個,結直腸癌12個,白血病15個,淋巴瘤9個,甲狀腺癌15個,黑色素瘤5個,腎癌27個,肝癌9個,胃癌3個,多發性骨髓瘤4個,胰腺癌7個……大夥自個上FDA官網和美國國家癌症研究院去數吧,若周邊有人患了這類已經找到靶點的癌症,那也算不幸中的萬幸了。
關於這數據有幾個說明:
第一,本僧老眼昏花,若統計有誤,真實數據隻多不少。
第二,同一個靶點,不同醫藥公司會開發出不同藥物,比如,已批準上市的針對EGFR靶點的藥物至少有20個。
第三,不同癌症可能是同一個靶點。比如,7號染色體短臂上的表皮生長因子受體EGFR基因,與細胞增殖和信號傳導密切相關,這個基因很容易突變(可能是殺人最多的基因了),一旦變成活躍狀態,就會導致細胞分裂不受控製,引發癌症。這事若發生在肺部,就是肺癌,若發生在胰腺,就是胰腺癌。所以癌症按照部位分類並不是很精準。
第四,新的靶點仍不斷被發現。舉個例子,德克薩斯大學和上海交通大學的聯合團隊發現了急性骨髓性白血病的一個新靶點:LILRB4,該成果發表於2018年10月《自然》雜誌,僅僅隻是半年前的事情。

看得出來,醫學的核心技術並不是材料技術。雖然日本的整體醫療環境是最好的,但從技術創新講,美帝仍然是一騎絕塵。中國雖然進步很快,但總體實力和美帝差距甚大。
癌細胞的反擊
靶向藥為特定癌細胞量身定做,這和破解密碼差不多,開發成本極高,可一旦癌細胞更改了密碼,那之前的工作就白費了。
事實上,總會有一些癌細胞能抗住靶向藥的攻擊,因為癌細胞可以躲到幾乎任何地方,而藥物卻不可能在每個地方都達到足夠殺死癌細胞的濃度,於是,癌細胞的耐藥性就出現了。
癌細胞有兩大依仗:更快的分裂速度、更高的突變概率,這本質上是加速了進化速度。如果繼續用靶向藥的思路去破解密碼,代價會越來越大,到頭來人類很可能就陷到了癌細胞的迷宮裏。
以死亡數最高的肺癌為例,EGFR基因突變導致的非小細胞肺癌是最常見的一種肺癌。第一代靶向藥很快問世了,2003年上市的易瑞沙,2004年上市的特羅凱,還有2011年上市的凱美納。
其中,凱美納是中國第一個小分子靶向藥,當時被衛生部長陳竺譽為民生領域的“兩彈一星”,是中國醫藥界一個不小的突破。

盡管是很了不起的事情,可患者在服用第一代肺癌藥後,幾乎全都出現了耐藥性。短則幾個月,長則幾十個月,EGFR基因就出現了新的變異,密碼一改,靶向藥自然就沒用了。
於是,2013年第二代肺癌藥阿法替尼上市,這顯然不是終點,2015年第三代肺癌藥奧希替尼上市,但依然無法阻止EGFR基因的突變,現在第四代肺癌藥也已經上路了,未來肯定還有第五代……
需要注意,第三代不見得比第一代先進,隻是因為癌細胞不停更換密碼,就需要用不同抗癌藥去破解,至於到底該吃第幾代,千萬聽醫生的,不可自作主張。
按這路數走,很難追上癌細胞的步伐,咋辦?毛主席教導我們,要讓敵人陷入人民戰爭的汪洋大海中。
人類的第一次總攻
反思一下人類對抗癌症的思路,都是用藥物直接攻擊癌細胞,而忽略了人體最強的武器:免疫係統。
免疫係統一旦投入戰鬥,不會放過任何一個入侵者,這就是人民戰爭的汪洋大海。
思路是挺好,但現實不太友好。
免疫係統運行的複雜性堪比國家政府,各種細胞分工合作的精細程度讓人咋舌,工程學告訴我們,越複雜的設備越容易出問題,免疫係統自然不會例外。
第一個漏洞
免疫係統的戰鬥原則一般是先識別再殺傷。如果免疫係統要對人體每一個細胞進行識別檢查,那肯定得累死,咱們攝入的食物不足以支撐如此高能耗的行動。所以,人體細胞進化出了一種自我檢查的能力,它們把檢查結果通過一種叫MHC的分子展示在細胞表麵。
這樣一來,免疫係統的工作量就大大降低了,隻要看一下細胞表麵的MHC分子就算完成了日常檢查。比如,如果有個細胞被病毒入侵了,那麽它呈現的MHC分子就會有異常信號,T細胞就會趕來把這個異常細胞殺死,完事後再讓吞噬細胞清理戰場,讓一切恢複如初。
再比如,正常細胞變成癌細胞後,呈現的MHC分子通常也會有異常信號,是的,“通常會有”,因為癌細胞瘋狂分裂,一定會產生很多亂七八糟的蛋白,所以產生的MHC信號必然會變異常,一旦這個信號被放出去,T細胞大軍就會趕來殺敵。
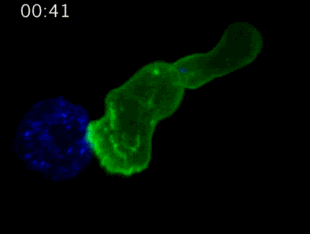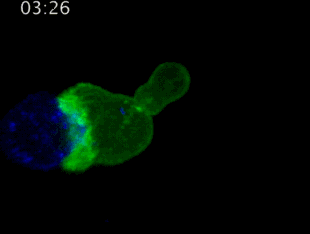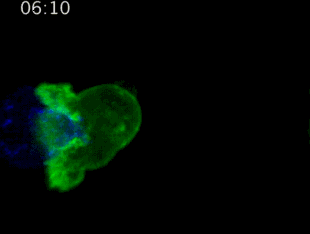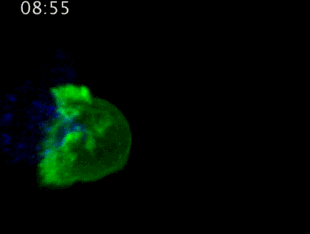
劍橋大學拍攝:T細胞(綠)衝向癌細胞(藍)
癌細胞當然不會坐以待斃,在“不通常”的情況下,癌細胞會抑製MHC信號的呈現,隻要不讓MHC信號送到細胞外麵,就能成功躲避免疫係統的檢查,然後也就沒T細胞啥事了。
我們姑且把這類癌細胞稱為:不放信號的癌細胞。
第二個漏洞
除了這些膽小的癌細胞,還有一些膽大的癌細胞,它們敢於和T細胞正麵硬抗。
T細胞因為殺傷力太強,稍有不慎就會對正常細胞造成誤傷,所以免疫係統進化出了一套暗號係統,沿途的正常細胞通過和T細胞對暗號,避免被誤傷。T細胞表麵用來對暗號的蛋白,學名:免疫檢查點。
正常細胞如果把暗號對錯了,T細胞也會毫不留情出手,這就是免疫缺陷疾病,如,類風濕關節炎、紅斑狼瘡。
在成千上萬的癌細胞中,也會有個別癌細胞蒙中暗號,躲過T細胞追殺。
我們姑且把這類癌細胞稱為:能對暗號的癌細胞。
實力尚存的免疫細胞
總結來說,癌細胞通過這兩個漏洞,隻是躲過了免疫係統的檢查和追殺,並不是在正麵戰場堂堂正正擊敗T細胞。換句話說,隻要免疫係統堵住漏洞,那麽T細胞殺死癌細胞依然和切菜一樣容易。
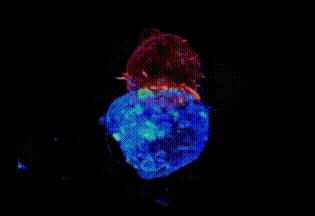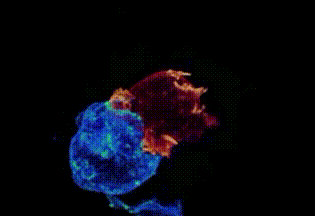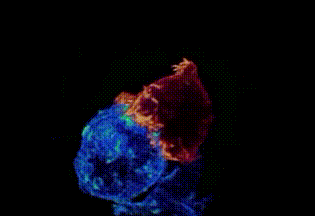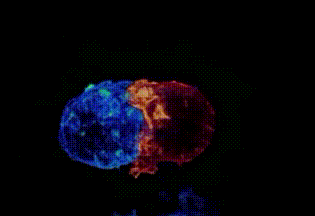
劍橋大學拍攝:T細胞(紅)纏住癌細胞(藍)搏鬥,綠色是T細胞釋放的毒素
這就是所謂的“免疫療法”。
免疫療法是人類第一次對癌症發起的總攻,意圖徹底解決所有癌症,隻是戰事並沒有那般順利。不過,這個詞已經被某某係醫院玩壞了,被說成了包治百病的萬能藥,大家先把之前的信息清空,且聽本僧從頭道來。
第一個補丁
2018年諾貝爾醫學獎頒給了美國的詹姆斯艾利森和日本的本庶佑,以表彰他們在癌症免疫療法上做出的開創性工作。免疫療法,是當年的十大科技突破之首。
艾莉森找到的CTLA-4蛋白是人類首個被發現的“免疫檢查點”,也就是癌細胞和T細胞對的暗號。艾莉森提出了一種全新的對抗癌症思路,他設計了一種藥物專門結合CTLA-4蛋白,破壞這個暗號係統,於是,T細胞就開始重新追殺癌細胞。
2011年FDA批準用於治療晚期黑色素瘤的新藥Yervoy,正是基於這個原理。

但事情很棘手,因為T細胞的CTLA-4蛋白被破壞,很多用CTLA-4暗號的正常細胞也被T細胞殺死了。很多患者得了嚴重的自身免疫缺陷疾病,癌症患者最忌諱的就是降低免疫力,這很容易引起癌細胞的反撲。
所幸,日本科學家本庶佑發現了另一個重要的暗號:PD-1。
PD-1是當前醫學界大熱的研究點,原因有二:第一,正常細胞不太喜歡用這個暗號;第二,癌細胞特別喜歡用這個暗號。
這還有啥好說的,2014年FDA批準了兩個新藥,歐狄沃和可瑞達,專門破壞T細胞上的PD-1蛋白,可以用來治療:黑色素瘤、非小細胞肺癌、結直腸癌、腎癌、肝癌、胃癌……
一種藥可以治療這麽多癌症,也就電線杆上的廣告才敢說。不過PD-1的廣告可不是貼在電線杆上的,而是美國前總統卡特的背書。

2015年8月,90歲高齡的美國前總統卡特診斷出黑色素瘤,這是一種惡性程度極高的癌症,晚期的五年生存率隻有5%!90歲的高齡無法化療,而且癌細胞已經擴散到肝髒和大腦,這情況,就是大羅神仙下凡,也隻能準備後事了。
但奇跡就這麽發生了,可瑞達治療僅僅4個月後,卡特體內的腫瘤徹底消失了!現在已經過去了4年半,卡特依然活奔亂跳,最近有消息說,94歲的卡特和朋友們去獵火雞而摔斷了臀骨……癌症估計是痊愈了。
當然,不是每個人都像卡特這麽幸運,晚期惡性黑色素瘤患者經過PD-1抑製劑治療後,五年生存率隻是提高到了30%-40%,而且有少部分患者出現了不同程度的免疫性炎症。因為很多用PD-1暗號的正常細胞也被T細胞殺死了,甚至還有萬分之六的概率導致免疫性心肌炎,這是一種死亡率極高的疾病。

科學家又仔細研究了癌細胞對暗號的過程,發現癌細胞是產生了一種叫PD-L1的蛋白去結合T細胞上的PD-1蛋白,也就是說,癌細胞是用PD-L1蛋白對的暗號,這下就好辦了。
2016年FDA批準了第一款PD-L1抑製劑,其原理是結合癌細胞的PD-L1蛋白,使癌細胞沒法對上T細胞的暗號。話說,小盆友能分得清PD-1和PD-L1的區別吧。
截止2018年底FDA批準的PD-1/PD-L1抑製劑已經有6款了。除此之外,2018年12月中國國家藥品監督管理局正式批準了國內首個自主研發的PD-1抑製劑,君實生物的拓益。和凱美納一樣,這也是中國醫藥界一個不小的突破。

PD-1/PD-L1抑製劑可以治療幾十種癌症,就是療效仍不穩定,很多時候T細胞麵對癌細胞還是有點發懵,可一旦有效基本就是治愈!本僧得強調一遍,一旦有效就是治愈,這是傳統化療藥無法比擬的優勢!
更重要的是,與癌症的這場戰爭中,人類終於看到了勝利的曙光,雖然隻是曙光。
第二個補丁
科學家除了對“能對暗號的癌細胞”窮追猛打,對“不放信號的癌細胞”也沒有手軟。
這類癌細胞因為不發出MHC信號而躲過了免疫係統的檢查,於是,科學家就把免疫細胞提取出來,直接人為加上一套新的識別係統,使其能找到不放MHC信號的隱藏癌細胞,這就是:嵌合抗原受體T細胞免疫療法,簡稱CAR-T。
美國小女孩Emily是全球第一個試驗CAR-T療法的兒童,這也讓CAR-T名聲大噪。
2012年6歲的Emily在急性淋巴性白血病兩次複發後,已是回天無術,瀕臨死亡。賓夕法尼亞大學的科學家在征求家人同意後,死馬當活馬醫,采用了當時並未被批準的CAR-T療法。
他們在癌細胞表麵發現了一個特殊的蛋白:CD19蛋白,於是科學家提取了Emily的免疫細胞後,加上了一套能識別CD19蛋白的係統,體外培養增殖後,再重新注入體內。
然後,重回體內的T細胞開始瘋狂攻擊任何帶有CD19蛋白的細胞,激烈的戰鬥使Emily身體狀況更加危急,靠著呼吸機熬過了2周。
隨後醫生給艾米麗使用了免疫抑製藥物,終於讓發狂的T細胞冷靜了下來。僅僅幾個小時,Emily的情況迅速好轉,在第二天的7歲生日時醒了過來。再一檢查,體內的癌細胞已經完全消失。
直到現在,癌症一直沒有複發,Emily每年都會拿著一塊“cancer free”的牌子來紀念這個奇跡。

2017年FDA正式批準了首個CAR-T療法。
CAR-T療法斬獲雖豐,但癌細胞還是頂住了攻勢,因為像CD19蛋白這樣的靶點並不好找。Emily的癌症是淋巴B細胞癌變引起的,而人體細胞隻有淋巴B細胞才有CD19蛋白,所以科學家才會把CD19蛋白作為靶點。可這樣會誤傷正常的淋巴B細胞,所以Emily必須要注射免疫球蛋白來維持免疫力。
CAR-T療法對淋巴B細胞引起的急性淋巴細胞白血病和非霍奇金淋巴瘤比較顯著,還有一些不太成熟的研究:以ERRB2為靶點治療肺癌,以前列腺特異性抗原為靶點治療前列腺癌,以CAIX為靶點治療腎癌,以Lewis Y為靶點治療卵巢癌,等等,要走的路還很長。
CAR-T目前無法為人類取得徹底勝利。
再打第二個補丁
頑強的科學家再次發動了新一輪攻勢。
癌細胞其實有很多異常蛋白,這些蛋白若是單獨出現,早就被免疫係統收拾幹淨了,正如進入體內的感冒病毒。但是因為有癌細胞的庇護,這些異常蛋白的MHC信號被屏蔽了。
這一輪進攻重點是:解除癌細胞的屏蔽。
科學家把癌細胞提取出來後,找出那些異常蛋白,然後人工合成,再把這些裸露的異常蛋白注入體內。這個工作極其複雜,複雜到本僧都不想多說。
這些異常蛋白大搖大擺進入體內,沒了癌細胞庇護,自然不可能躲過免疫係統的偵查,很快蛋白特征就匯報給了總部。接著,T細胞大軍出征,攻擊任何帶有這種蛋白特征的入侵者。於是,一臉懵逼的癌細胞就糟了池魚之殃。
這過程和疫苗原理有幾分類似,被稱為“個性化癌症疫苗”,但其實這不算疫苗。
美國波士頓達納-法伯癌症研究所和德國緬因茲大學,首次在臨床試驗中使用癌症疫苗治療取得成功,兩組團隊的研究成果同時發表在2017年7月的《自然》上。

一共有19位黑色素瘤患者參與試驗,美國科學家為每位患者找到了20多種異常蛋白,德國科學家則找到了10多種異常蛋白,將這些蛋白重新注入人體後,激發了T細胞的強烈應答。
19位患者中,12人腫瘤完全消失且無複發,3人在接受輔助治療後腫瘤也完全消失,1人腫瘤明顯縮小,還有3人實在是病情過於嚴重。
這無疑讓人類戰勝癌症的曙光又多了幾分。
攻守之勢異也
癌細胞和免疫係統的對抗很像是電子對抗,雙方都在破解對方的密碼。
靶向藥是我們破解了癌細胞的密碼,所以癌細胞隻要更改密碼就會產生耐藥性,搞得我們很被動。
免疫療法則剛好相反,癌細胞破了免疫係統的密碼才發展成癌症,當我們更改了免疫係統的密碼,T細胞又重新殺得癌細胞丟盔棄甲。
不過,就是太貴了,聽說五百萬級別......
最新戰況
人類對癌症的第一波總攻可謂氣勢洶洶,攻城掠地,戰功碩碩,但殊死搏鬥的癌細胞也爆發出了驚人戰力。
2019年3月《自然》雜誌為我們呈現了最新戰況。在美國小女孩Emily身上創造奇跡的CAR-T細胞免疫療法遭遇了有史以來最激烈的反撲,複發案例屢見不鮮。
你絕對想不到,狡猾的癌細胞將CD19蛋白這個靶點轉移到了T細胞身上,使得T細胞自相殘殺,直至消耗殆盡,殘存的癌細胞趁機再度壯大。

現在,科學家又在謀劃新一輪的反攻方案。加州大學已經從免疫係統裏又找到了一位戰力爆表的盟友:自然殺傷細胞。這哥們兒已經展現出比T細胞還要強大的潛力,很可能是下一次進攻的主力之一。
戰略相持
無論悲觀者把癌症描繪得多恐怖,也無論樂觀者把免疫療法說得多神奇,本僧個人以為,人類與癌症的這場戰爭至少是進入戰略相持階段了,人類雖然收複了很多陣地,但依然有不少啃不動的硬骨頭。
本文特意加了很多時間點,仔細看看這些時間點,我們可以明顯感受到人類對抗癌症時那種蓬勃向上的氣象!
為什麽我總是呼籲大家熱愛科學,今天總算找到了最硬的理由:將來有一天,當我們遭遇癌症的時候,你就會從心底裏期盼,期盼科技能發展得再快一點!也許多活一天,就能聽到人類反攻的號角:死神,再見!
